Podle způsobu spojení aminokyseliny a cukru lze cukerný peptid rozdělit do čtyř kategorií: O glykosylace, C a N glykosylace, rosné sacharifikace a GPI (glykofosfatidlyinositol) spojení.
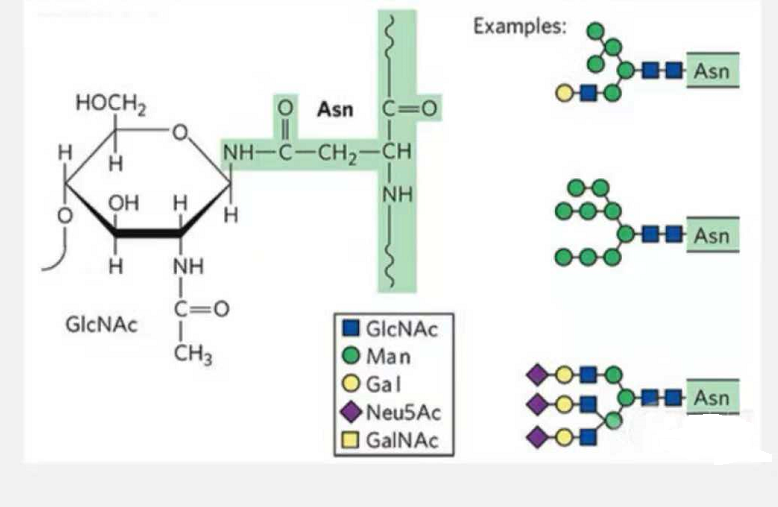
1. N-glykosylační glykopeptidy jsou složeny z N-acetamidové glukózy na redukujícím konci glykanového řetězce (Glc-Nac) spojeného s atomem N na amidové skupině postranního řetězce některých Asn v peptidovém řetězci a Asn schopné spojit glykanový řetězec musí být umístěny v AsN-X-Ser/Thr (X! =P) v motivu tvořeném zbytky.Cukr je N-acetylglukosamin.
N-glykosylací modifikovaný strukturní glykopeptid
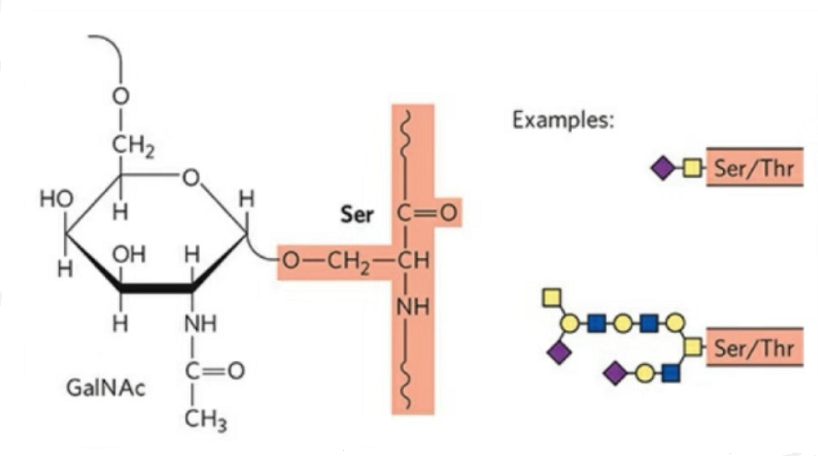
2. Struktura O-glykosylace je jednodušší než N-glykosylace.Tento glykopeptid je obecně kratší než glykan, ale má více typů než N-glykosylace.Ser a Thr mohou být obecně glykosylovány v peptidovém řetězci.Kromě toho existují glykopeptidy zdobené tyrosinovou, hydroxylovou a hydroxyprolinovou glykosylací.Pozicí vazby je hydroxylový atom kyslíku na postranním řetězci zbytku.Vázané cukry jsou galaktóza nebo N-acetylgalaktosamin (Gal&GalNAc) nebo glukosa/glukosamin (Glc/GlcNAc), manóza/manosamin (Man/ManNAc) atd.
O-glykosylace modifikuje strukturu
3. Glykopeptid O-GlcNAC glykosylace ((N-acetylcystein (NAC)) (glcnAcN-acetylglukosamin/acetylglukosamin)
Jediná glykosylace N-acetylglukosaminu (GlcNAc) spojuje proteiny O-GlcNAc s hydroxylovým atomem kyslíku serinového nebo threoninového zbytku proteinu.O-GlcNA glykosylace je O-GlcNAc monosacharidový ornament bez glykanové extenze;Podobně jako fosforylace peptidů je O-GlcNAc glykosylace glykopeptidů také dynamickým procesem zdobení proteinů.Abnormální dekorace O-GlcNAc může způsobit řadu onemocnění, jako je cukrovka, kardiovaskulární onemocnění, nádory, Alzheimerova choroba a tak dále.
Glykosylační body glykopeptidů
Základní struktury polypeptidových a cukerných řetězců jsou spojeny s proteinovými řetězci kovalentními vazbami a místa spojující cukerné řetězce se nazývají glykosylační místa.Protože neexistuje žádný templát, který by sledoval biosyntézu glykopeptidových cukerných řetězců, různé cukerné řetězce budou připojeny ke stejnému glykosylačnímu místu, což vede k takzvané mikroskopické nehomogenitě.
Glykosylace glykopeptidů
1. Vliv glykosylace glykopeptidu na účinnost terapie terapeutickými proteiny
V případě terapeuticko-terapeutických proteinů glykosylace také ovlivňuje poločas a cílení proteinových léčiv in vivo
2. Glykosylace rozpustných glykopeptidů a proteinů
Studie ukázaly, že cukerné řetězce na povrchu proteinů mohou zlepšit molekulární rozpustnost proteinů
3. Glykopeptidová glykosylace a proteinová imunogenicita
Na jedné straně mohou cukerné řetězce na povrchu proteinů vyvolat specifické imunitní reakce.Na druhou stranu cukerné řetězce mohou pokrýt určité povrchy na povrchu proteinu a snížit jeho imunogenicitu
4. Glykopeptidová glykosylace, která zvyšuje stabilitu proteinu
Glykosylace může zvýšit stabilitu proteinů vůči různým podmínkám denaturace (jako jsou denaturační činidla, teplo atd.) a zabránit agregaci proteinů.Cukerné řetězce na povrchu proteinů zároveň mohou pokrýt i některá místa proteolytické degradace proteinových molekul, a tím zvýšit odolnost proteinů vůči proteinázám.
5. Glykopeptidová glykosylace, která ovlivňuje biologickou aktivitu proteinových molekul
Změna glykosylace proteinu může také umožnit molekulám proteinů vytvářet nové biologické aktivity
Čas odeslání: srpen-03-2023