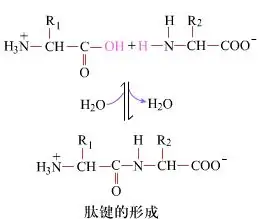
Na povrchu je tvorba peptidových vazeb za vzniku dipeptidů jednoduchým chemickým procesem.To znamená, že dvě aminokyselinové složky jsou spojeny peptidovou vazbou, amidovou vazbou, zatímco jsou dehydratovány.
Tvorba peptidové vazby je aktivace aminokyseliny za mírných reakčních podmínek.(A) karboxylová skupina, druhá aminokyselina (B) Nukleofilně aktivovaná karboxylová skupina pak tvoří dipeptid (AB)."Pokud karboxylová složka (A) není chráněna, nelze tvorbu peptidové vazby kontrolovat."Vedlejší produkty, jako jsou lineární a cyklické peptidy, mohou být smíchány s cílovými sloučeninami AB.Proto musí být všechny funkční skupiny, které se nepodílejí na tvorbě peptidové vazby, během syntézy peptidu dočasně reverzibilně chráněny.
Takže syntéza peptidů – tvorba každé peptidové vazby – zahrnuje tři kroky agregace.
Prvním krokem je připravit některé aminokyseliny, které potřebují ochranu, a zwitteriontová struktura aminokyselin již neexistuje.
Druhým krokem je dvoukroková reakce za vzniku peptidových vazeb, při které se nejprve aktivuje karboxylová skupina N-chráněné aminokyseliny na aktivní meziprodukt a poté se vytvoří peptidová vazba.Tato spřažená reakce může probíhat buď jako jednokroková reakce nebo jako dvě následné reakce.
Třetím krokem je selektivní odstranění nebo úplné odstranění ochranné základny.I když k úplnému odstranění může dojít až po sestavení všech peptidových řetězců, je také nutné selektivní odstranění ochranných skupin, aby se pokračovalo v syntéze peptidu.
Protože 10 aminokyselin (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec a Cys) obsahuje funkční skupiny postranních řetězců, které vyžadují selektivní ochranu, čímž je syntéza peptidů komplikovanější.Z důvodu různých požadavků na selektivitu je třeba rozlišovat dočasné a semipermanentní základy ochrany.Dočasné ochranné skupiny se použijí v dalším kroku k vyjádření dočasné ochrany aminokyselinových nebo karboxylových funkčních skupin.Semipermanentní ochranné skupiny jsou odstraněny bez zásahu do již vytvořených peptidových vazeb nebo postranních řetězců aminokyselin, někdy během syntézy.
"V ideálním případě by aktivace karboxylové složky a následná tvorba peptidových vazeb (kopulační reakce) měla být rychlá, bez tvorby racemických nebo vedlejších produktů a pro dosažení vysokých výtěžků by měly být použity molární reaktanty."Bohužel žádná z chemických vazebných metod nesplňuje tyto požadavky a jen málo z nich je vhodných pro praktickou syntézu.
Během syntézy peptidů jsou funkční skupiny zapojené do různých reakcí obvykle spojeny s manuálním centrem, glycin je jedinou výjimkou a existuje potenciální riziko rotace.
Posledním krokem v cyklu syntézy peptidu je odstranění všech ochranných skupin.Selektivní odstranění chránících skupin je důležité pro prodloužení peptidového řetězce vedle požadavku na úplné odstranění ochrany při syntéze dipeptidů.Syntetické strategie by měly být pečlivě naplánovány.V závislosti na strategické volbě může N selektivně odstraňovat a-amino nebo karboxylové chránící skupiny.Pojem „strategie“ označuje sekvenci kondenzačních reakcí jednotlivých aminokyselin.Obecně je rozdíl mezi postupnou syntézou a kondenzací fragmentů.Syntéza peptidů (také známá jako „konvenční syntéza“) probíhá v roztoku.Ve většině případů lze postupné prodlužování peptidového řetězce syntetizovat pouze použitím peptidového řetězce k syntéze kratších fragmentů.Pro syntézu delších peptidů musí být cílové molekuly segmentovány na vhodné fragmenty a musí být stanoveno, že mohou minimalizovat stupeň diferenciace na C konci.Po postupném sestavení jednotlivých fragmentů dojde ke spojení cílové sloučeniny.Strategie syntézy peptidů zahrnuje výběr nejlepšího a nejvhodnějšího ochranného fragmentu a strategie syntézy peptidu zahrnuje výběr nejvhodnější kombinace ochranných bází a nejlepšího způsobu konjugace fragmentů.
Čas odeslání: 19. července 2023